Nyhet -
Hur Trisomi 21 påverkar cellernas proteiner
Syntes och reglering av proteiner
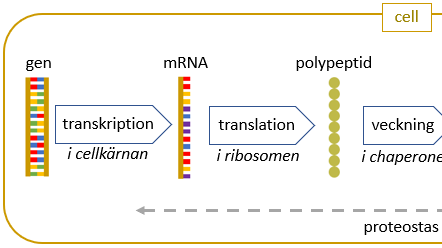
Man vet inte i detalj hur personer med en extra kromosom 21 får Downs syndrom. Man antar att det ökade uttrycket av doskänsliga gener på kromosom 21 ger upphov till de egenskaper som förknippas med syndromet. En gen kommer till uttryck genom att dess DNA först transkriberas till messenger-RNA. mRNA tar sig ut ur cellkärnan och översätts i ribosomen (translation), så att aminosyror kopplas ihop i rätt ordning till en polypeptid. Polypeptiden veckas och kan modifieras ytterligare med hjälp av chaperoner för att bli ett aktivt protein som kan fylla sin uppgift i kroppen.
Proteiner bryts ned om de är felveckade, har trasslat ihop sig, har blivit skadade, eller finns i överflöd. Cellens stabiliserande reglering av proteinerna kallas proteostas. Till proteostasens mekanismer räknas translation, veckning och nedbrytning. Alla proteiner i till exempel en cell vid en given tidpunkt kallas för cellens proteom. Det finns mer än 20.000 proteiner i kroppen och med hjälp av ny teknik har det blivit möjligt att studera stora mängder proteiner i exempelvis en cell.
Downs syndrom medför ett förändrat sjukdomsspektrum, med minskad risk för vissa sjukdomar och ökad risk för andra. För att öka hälsan och medellivslängden hos personer med Downs syndrom behöver man förstå uppkomsten av de sjukdomar där risken är förhöjd. Studier av cellernas proteiner är ett sätt att öka kunskapen om hur de sjukdomarna utvecklas.
Från gener till proteiner vid Trisomi 21
Forskare i Schweiz, Tyskland och Italien har studerat proteiner i bindvävsceller (fibroblaster) med Trisomi 21 (T21). De har jämfört förekomsten av olika proteiner, dels i celler från 11 barn med Downs syndrom och 11 barn utan DS (kontroller, matchade för kön och ålder), och dels i celler från enäggstvillingar där bara den ena tvillingen hade Trisomi 21. På så vis kunde de jämföra hur Trisomi 21 påverkar proteinerna i celler med samma genetiska bakgrund, respektive i celler med helt olika genetisk bakgrund.
Forskarna lyckades mäta mängden av 4056 olika proteiner i alla de studerade cellerna. När man jämförde koncentrationen av olika proteiner med data om hur mycket motsvarande gener transkriberas i bindvävsceller, så var korrelationen måttlig (34 – 51%) mellan mängden mRNA och mängden protein.
Proteiner kodade av kromosom 21 påverkar gener på andra kromosomer och detta förändrar också proteomet. I tvillingcellerna kunde man se att Trisomi 21 ökade mängden av mer än 500 proteiner som kodas av de andra kromosomerna och minskade mängden av drygt 300. När man gjorde samma jämförelser mellan cellerna från barnen (med och utan Trisomi 21) som inte var släkt så kunde man inte identifiera lika många proteiner från andra kromosomer som var påverkade av Trisomi 21. Trisomi 21 påverkar individer delvis olika, och den påverkan kan också maskeras av all annan individuell variation. Sedan mätte man i tvillingcellerna hur fort 2200 olika proteiner bröts ned. Omsättningen av proteiner var generellt snabbare i T21-cellerna, och 60% av proteinerna hade en snabbare nedbrytning.
Forskarna undersökte sedan effekten av Trisomi 21 på enbart de proteiner som kodas av gener på kromosom 21. Med olika tekniker undersökte man 19-25 % av de 228 proteinkodande generna på kromosom 21. Cellerna från tvillingen med DS hade 3/2 = 1,50 så många genkopior som tvillingen utan DS, men i genomsnitt bara 1,38 så mycket mRNA, och endast 1,13 så mycket proteiner, samt 1,07 så stor nedbrytning. När man analyserade enskilda proteiner fann man dels sådana som hade förhöjda värden genom hela syntesen, från transkription till veckning, dels sådana vars proteinmängder var starkt förhöjda (runt 3) trots att transkriptionen inte var särskilt förhöjd (runt 1), vilket tyder på en betydande uppreglering efter transkriptionen. Ytterligare några proteiner hade opåverkade proteinnivåer (runt 0,9) trots starkt ökad transkription (runt 1,3). Dessa proteiner hade också störst ökning av nedbrytningen. Sammanfattningsvis så finns det flera olika mönster för genernas uttryck, vilket pekar på en komplex och varierande reglering av proteinerna.

Det har tidigare rapporterats att protein-komplex kan buffra avvikelser, så forskarna sorterade sedan proteinerna i två grupper: de som bildar stabila protein-komplex, och de som inte gör det. För proteiner som ingår i stabila protein-komplex, så var mängderna av proteiner från kromosom 21 jämförbara med mängderna från övriga kromosomer. För proteiner som inte ingår i stabila protein-komplex däremot, var mängderna från kromosom 21 signifikant uppreglerade. Motsvarande samband hittade man också i cellerna från barnen som inte var släkt. Ett överskott av proteiner som bildar stabila protein-komplex bryts effektivt ned, men inte ett överskott av de proteiner som inte bildar komplex.
Vilka effekter får det förändrade proteomet vid Trisomi 21? Forskarna analyserade funktioner och processer kopplade till de proteiner som avvek mest, uppåt eller nedåt. Gemensamt för alla T21-celler, från de 11 barnen som inte var släkt samt tvillingen, var påverkan på cell-cykeln, translationen i ribosomerna, och cellandningen i mitokondrierna. Man identifierade många nedreglerade proteiner i de olika proteinkomplexen i mitokondriernas elektrontransportkedjor. Enligt forskarna framstår nedregleringen av mitokondrierna som en av de viktigaste effekterna av Trisomi 21. Det är ganska väl känt hur man kan påverka mitokondrierna och det är möjligt att detta kan vara en väg till behandling och bättre hälsa för personer med Downs syndrom.
Oxidativ stress kan skada proteinnedbrytningen
Ansamling av skadade och hoptrasslade proteiner, dåligt fungerande nedbrytningssystem i cellerna, och oxidativ stress kan kopplas till neurodegenerativa sjukdomar. Därför undersökte forskare från Italien och Kentucky, USA, hur proteiner oxiderats i nervceller från frontalloben hos 8 avlidna personer med DS (2-44 år, medelvärde 23 år) och jämförde med 8 avlidna personer utan DS (9-39 år, medelvärde 25 år). Deras hypotes var att tidiga störningar i proteostasen, möjligen kopplade till oxidativ stress, sker i hjärnan hos personer med DS innan amyloida plack och annan Alzheimer- patologi utvecklas. Deras analyser visade att sex proteiner var betydligt mer oxiderade hos personer med DS än hos kontrollerna. Fem av dessa proteiner ingår i cellernas system för kontroll av proteinernas kvalitet.
Nybildade proteiner som behöver transporteras, till någon organell i cellen eller ut ur cellen, byggs upp i det endoplasmatiska nätverket (ER), genom att ribosomen dockar där och sen matar ut polypeptiden inne i ER. Veckning av polypeptiden påbörjas direkt när den matas ut, och följs av olika modifieringar, med stöd av enzymer och chaperoner. Om något går fel så upptäcks det inne i ER och chaperoner försöker rätta till veckningen. Om det ändå inte går att få ordning på proteinets form, så för en särskild chaperon proteinet ut ur ER till cytosolen (cellvätskan). Där taggas proteinet med ubiquitin så att en proteasom fångar upp det och bryter ned det (Ubiquitin-Proteasom-Systemet – UPS).
Om det vanliga kvalitetssystemet inte räcker till och mängden felaktiga proteiner fortsätter att öka så triggas det som kallas Unfolded Protein Response (UPR). UPR har tre parallella spår för att lösa problemen; 1) öka produktion av chaperoner, 2) dra ner på övrig proteinsyntes och stoppa cellcykeln, 3) öka hastigheten i utsorteringen av felaktiga proteiner. Om det ändå tar för lång tid att få proteostasen i balans, så växlar UPR istället från att rädda cellen till att genomföra en programmerad celldöd (typ I - apoptos) och cellen dör. Proteasomen bryter bara ned proteiner. Lysosomen kan bryta ned hela organeller, stora molekyler och bakterier. När organell-delar och cellens proteiner bryts ned och återvinns i lysosomen kallas processen autofagi. Även autofagi kan växla till programmerad celldöd (typ II) under oxidativ stress.
 Bilderna på proteinerna UCH-L1 och CatD kommer från Wikimedia.
Bilderna på proteinerna UCH-L1 och CatD kommer från Wikimedia.
Proteinerna som var betydligt mer oxiderade hos personer med DS än hos kontrollerna har följande kopplingar till proteostasen: Chaperonen GRP78 är ett av de första proteinerna som aktiveras vid stress i ER. GRP78 är viktigt för att trigga såväl Ubiquitin-Proteasom-Systemet (UPS) som Unfolded Protein Response (UPR), och nödvändigt för att trigga autofagi. Enzymet UCH-L1 har en viktig roll i återvinningen av ubiquitin, och den oxidativa förändringen av UCH-L1 medför sannolikt försämrad förmåga för proteasomen att bryta ned proteiner. Enzymet Vo-ATPase fungerar som en protonpump och är nödvändig för att lysosomen ska kunna hålla tillräckligt lågt pH för en fungerande autofagi. Forskarna tror att oxideringen av Vo-ATPase försämrar lysosomens förmåga att bryta ned proteiner. Proteinet GFAP har en viktig roll i att reglera ”chaperone-mediated autophagy” (CMA) som bryter ned proteiner från cellvätskan/cytosolen. CMA aktiveras som ett försvar mot oxidativ stress och behövs för att fånga in oxiderade proteiner åt lysosomen. Om GFAP oxideras så är det möjligt att det bidrar till en störning av autofagi-processerna. Enzymet CatD finns normalt i lysosomen och bryter ned protein. Till skillnad mot de övriga oxiderade proteinerna, så ledde dock oxidering av CatD i DS-cellerna till ökad aktivitet.
Oxidativa skador på proteiner drabbar alltså främst proteasom- och autofagisystemen i nervceller hos personer med DS, vilket bidrar till störningar i proteostas-nätverket. Dessa störningar sker tidigt och det är möjligt att de bidrar till neurodegenerativa processer. Forskarna föreslår att ackumuleringen av tilltrasslat Tau-protein och plack av beta-amyloid vid Alzheimers sjukdom inte bara beror på ökad produktion utan också på störningar i nedbrytningssystemen.
Ett stressat kvalitetssystem för proteiner
Förändringar i proteostasen förekommer i sjukdomar som till exempel diabetes, Alzheimers, nedsatt funktion i sköldkörteln, och epilepsi. Eftersom dessa sjukdomar är vanligare hos personer med Downs syndrom så ville forskare i Colorado, USA, testa hypotesen att celler från personer med DS har ett dysfunktionellt proteostas-nätverk. Proteostas-nätverket omfattar mer än 1400 komponenter i ribosomer, chaperoner, co-chaperoner, proteasomer och autofagosomer/lysosomer. Forskarna analyserade bindvävsceller och lymfocyter från tre personer med DS (7-18 år) och jämförde med celler från tre personer utan DS i samma ålder för att förstå hur Trisomi 21 påverkar olika komponenter i proteostasen.
Undersökningar av lymfocyterna visade att DS-cellerna hade en ökad basal nivå av oxidativ stress med ökad mängd av väteperoxid (H2O2), och en liten men signifikant ökning av transkriptionen av sju gener som aktiveras vid stress i endoplasmatiska nätverket (ER). Detta indikerar ett konstant påslag av Unfolded Protein Response (UPR). Forskarna stressade cellerna med ett särskilt ämne för att se om DS-cellerna klarade av att svara med en ytterligare ökning av UPR och det fungerade bra.
Sedan undersökte man mängderna av proteinerna för de sju aktiverade UPR-generna, i lymfocyter och bindvävsceller. Ett protein förekom i ökad mängd; XBP1. Den aktiva formen XBP1s är en transkriptionsfaktor och förekom i ökad mängd i DS-cellernas cellkärnor jämfört med i kontrollcellernas. Forskarna jämförde också förekomsten av XBP1s i hjärnor från DS-möss och hjärnor från ”vilda” möss, och den var signifikant ökad hos DS-mössen också. XBP1s har en skyddande effekt vid demens på två sätt, dels genom att den reglerar BDNF som är viktigt för hjärnans funktion, och dels genom att den reglerar ADAM10 som klyver APP i ofarliga bitar.
Proteostas-nätverket omfattar mer än 300 chaperoner och många av dessa är Heat Shock Proteins (HSP). De svarar på olika former av stress som till exempel värme. Forskarna undersökte basala nivåer för ett urval av dessa och hittade bara avvikelser för HSP27 som var signifikant nedreglerad i DS-cellerna. Forskarna stimulerade bindvävscellerna med en temperatur på 40 grader Celsius i två timmar och fann att DS-cellerna inte reagerade som kontrollcellerna. Kontrollcellerna svarade med en ökad mängd chaperoner, men det gjorde inte DS-cellerna. Cellerna utsattes också i 24 timmar för två ämnen som signalerar stress i ER. DS-cellerna var mer sårbara för denna påfrestning och visade betydligt sämre livskraft. Det är möjligt att de låga nivåerna av HSP27 bidrar till detta.
Felveckade proteiner ska märkas med ubiquitin för att brytas ned av 26S-proteasomen. Forskarna jämförde därför förmågan att ubiquitinera och bryta ned proteiner hos DS- och kontroll-bindvävsceller. DS-cellerna hade en ökad mängd ubiquitinerade proteiner, men nedbrytningen i proteasomerna var ineffektiv. Det finns flera tänkbara förklaringar till den försämrade funktionen i proteasomerna: överbelastning på grund av att mängden felveckade proteiner är så stor, brist på ATP vilket är den energi som driver proteasomen, och förändringar av proteasomen på grund av oxidativ stress.
Proteostas-nätverket i DS-celler har svårt att hantera de felveckade proteinerna effektivt och detta kan vara kopplat till olika sjukdomar som är vanligare hos personer med DS. Fler undersökningar av de olika mekanismerna behövs. Forskarna föreslår att en ambitiös ansats för att hjälpa personer med DS att undgå flera sjukdomar, kan vara att hitta ämnen som minskar störningen av proteostasen och förstärker förmågan till korrekt veckning av proteiner och effektiv nedbrytning av proteiner.
Proteinerna i blodet tyder på autoinflammation
Personer med Downs syndrom har högre risk att få autoimmuna sjukdomar som till exempel glutenintolerans, diabetes typ 1, Hashimotos tyreodit, alopecia areata, och ledgångsreumatism. När en annan forskargrupp i Colorado, USA, studerade transkriptionen i fyra sorters celler med Trisomi 21, så fann de att en fjärdedel av alla uppreglerade gener kunde kopplas till interferon-signalering. Interferoner är signalproteiner som celler producerar när de är under attack av till exempel virus. Interferonet startar en kaskad av försvarsmekanismer i omkringliggande celler. Hundratals gener aktiveras för bekämpning av smittämnet, samtidigt som proteinsyntesen i ribosomerna minskas. En hyperaktiverad interferon-respons kan beskrivas som att celler med Trisomi 21 ständigt kämpar mot en virusinfektion som inte existerar. Forskarna tror att det finns ett samband mellan en hyperaktiverad interferon-respons och autoimmuna sjukdomar.
Forskarna har nu undersökt förekomsten av 3585 proteiner i blodplasma och blodserum från 165 personer med DS (1-21 år) och jämfört med 98 personer utan DS (kontrollgrupp), och därigenom funnit 299 proteiner med avvikande mängder. 178 var nedreglerade och 121 var uppreglerade, varav endast 9 kom från kromosom 21. De flesta proteiner med avvikelser kodas alltså av övriga kromosomer, vilket tyder på att avvikelser uppstår nedströms från T21 i olika signalkedjor (signaltransduktion). När de undersökte vilka funktioner de avvikande proteinerna kunde kopplas till, fann de fyra breda kategorier som berörde 215 av proteinerna; immunkontroll, komplementsystemet och koagulering, tillväxtfaktor-signalering, och reglering av nervcellsbildning.

Bilden Signaltransduktion från Wikimedia.
Immunkontroll var den största kategorin och involverade 150 av proteinerna. Proteinerna indikerar ett kroniskt aktivt immunsystem och en möjlig predisposition för autoimmunitet. Man såg mängdavvikelser i proteiner kodade av gener som kopplats till bland annat autoimmun sköldkörtelsjukdom, ledgångsreumatism, SLE, psoriasis, inflammatorisk tarmsjukdom och diabetes typ 1. Man fann signifikant ökade nivåer av flera starkt inflammatoriska cytokiner som ingår i interferon-signaleringen. Dessutom kunde man koppla andra avvikande proteiner indirekt till interferon-signaleringen, som exempelvis CST3. CST3-nivån är klart höjd vid T21 vilket indikerar minskad filtrering i njurarna, och det är känt att hyperaktiv interferon-signalering påverkar njurarna vid en del njursjukdomar.
Komplement och koagulerings-kaskaden var påverkad av 21 proteiner, varav 18 var nedreglerade. Komplementsystemet är nedreglerat vid Trisomi 21. Komplementsystemet är den del av immunsystemet som är medfött och inte förändras under livet (till skillnad från det adaptiva immunsystemet som utvecklar antikroppar mot smittämnen och kan ge immunitet). Ett nedreglerat komplementsystem är ett kännetecken för komplexa immunsjukdomar, inklusive interferon-driven SLE, och Interferon typ I-sjukdomar. Det nedreglerade komplementsystemet skulle kunna förklara den ökade risken för lunginflammation orsakad av streptokocker, och öroninflammation. Njurarna löper särskild risk att skadas vid problem i komplementsystemet. Det finns också kopplingar mellan komplementsystemet och Alzheimers sjukdom, till exempel när synapserna bryts ned. Forskarna fann också att flera proteiner var nedreglerade i koagulerings-kaskaden.

Tillväxtfaktorer påverkas av 75 proteiner med avvikelser. Ibland är tillväxtfaktorns ligand nedreglerad. I andra fall är liganden uppreglerad men receptorn nedreglerad. 17 av de 75 proteiner som påverkar tillväxtfaktorsignaleringen är också kopplade till regleringen av nervcellsbildningen. Till exempel är ett par viktiga receptorer och en kinas nedreglerade.
Forskarna tror att den hyperaktiverade interferon-responsen kan ligga bakom den ökade risken för autoimmuna sjukdomar, och att responsen antagligen orsakas av att generna för fyra interferonreceptorer finns på kromosom 21. Studien av proteinerna i blodplasma och serum från personer med Downs syndrom visar på en genomgripande påverkan på immunsystemet, och har genererat många hypoteser om utvecklingen av sjukdomar som personer med DS har ökad risk för. Studien motiverar också framtida undersökningar för att se om immunmodifierande behandlingar med interferon-antagonister kan göra nytta för personer med DS, enligt forskarna.
Man vet inte riktigt hur personer med en extra kromosom 21 får Downs syndrom. Man vet inte heller hur de sjukdomar uppstår som är vanligare hos personer med DS. När forskare förstår proteinerna bättre och vad som verkligen sker i cellerna på molekylnivå, så ökar möjligheterna att utveckla läkemedel som kan förbättra hälsan hos personer med DS.
Läs mer:
Systematic proteome and proteostasis profiling in human Trisomy 21 fibroblast cells. (2017, Oct: Liu Y, Borel C, Li L, Müller T, Williams EG, Germain PL, Buljan M, Sajic T, Boersema PJ, Shao W, Faini M, Testa G, Beyer A, Antonarakis SE, Aebersold R., PMID29089484, PMC5663699)
Impairment of proteostasis network in Down syndrome prior to development of Alzheimer’s disease neuropathology: Redox proteomics analysis of human brain. (2013, Aug: Di Domenico F, Coccia R, Cocciolo A, Murphy MP, Cenini G, Head E, Butterfield DA, Giorgi A, Schinina ME, Mancuso C, Cini C, Perluigi M., PMID23603808, PMC3940071)
The burden of trisomy 21 disrupts the proteostasis network in Down syndrome. (2017, Apr: Aivazidis S, Coughlan CM, Rauniyar AK, Jiang H, Liggett LA, Maclean KN, Roede JR., PMID28430800, PMC5400264)
Trisomy 21 causes changes in the circulating proteome indicative of chronic autoinflammation. (2017, Nov: Sullivan KD, Evans D, Pandey A, Hraha TH, Smith KP, Markham N, Rachubinski AL, Wolter-Warmerdam K, Hickey F, Espinosa JM, Blumenthal T., PMID29093484, PMC5665944)
Tidigare på Svenska Downföreningens hemsida:
Brist på energi (Feb 2017)
Idrott är bra för både kropp och knopp (Mar 2016)
På väg mot behandling av Trisomi 21 (Jan 2016)
Oxidativ stress är utmärkande för Downs syndrom (Nov 2015)
Downs syndrom ger 6 ggr högre risk för Celiaki (Maj 2012)
